Zawiadomienie dotyczące bezpieczeństwa urządzeń medycznych
Urządzenia Philips Respironics Sleep and Respiratory Care
Po wykryciu w czerwcu 2021 r. dwóch potencjalnie niebezpiecznych dla zdrowia problemów związanych z elementem występującym w określonych urządzeniach do wentylacji CPAP, BiPAP oraz respiratorach do wentylacji mechanicznej firma Philips opublikowała zawiadomienie dotyczące bezpieczeństwa (poza USA) / wycofania urządzenia (tylko w USA).
Bezpieczeństwo pacjentów jest naszym najwyższym priorytetem, dlatego zobowiązujemy się wspierać naszych pacjentów, dostawców medycznego sprzętu trwałego (ang. durable medical equipment providers, DME), dostawców sprzętu do opieki domowej oraz personel medyczny w trakcie akcji naprawczej.
Wsparcie to będzie obejmować udostępnianie aktualnych, dokładnych informacji w formie wskazówek oraz kolejnych podejmowanych kroków. Dziękujemy za cierpliwość i wierzymy, że nasze starania pozwolą odbudować Państwa zaufanie.
Urządzenie nie jest zarejestrowane?
Dodatkowe informacje dla…

Pacjent


Pytania i odpowiedzi
Zawiadomienie dotyczące bezpieczeństwa / wycofania urządzeń dotyczy produktów wymienionych poniżej:
Aparaty do wentylacji CPAP i BiLevel PAP
Wszystkie urządzenia, których dotyczy problem, wyprodukowane przed 26 kwietnia 2021 r. (wszystkie numery seryjne)
Respirator do wentylacji ciągłej, minimalne wspomaganie wentylacji, do stosowania w placówkach ochrony zdrowia
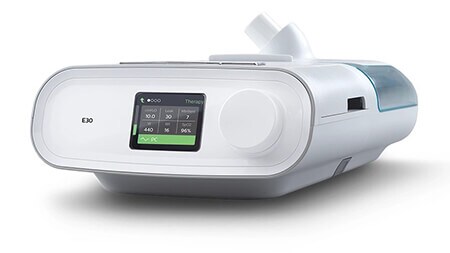
E30
(zezwolenie na użycie w sytuacji wyjątkowej)

DreamStation ASV
Znany także pod nazwą DreamStation BiPAP autoSV

DreamStation ST, AVAPS
Znany także pod nazwą DreamStation BiPAP AVAPS,DreamStation BiPAP S/T

SystemOne ASV4
Znany także pod nazwą System One BiPAP autoSV,System One BiPAP autoSV Advanced

C Series S/T, AVAPS
Znany także pod nazwą System One BiPAP AVAPS (C-Series), System One BiPAP S/T (C-Series)

OmniLab Advanced Plus
Stacjonarne urządzenie do miareczkowania
Respirator do wentylacji ciągłej, minimalne wspomaganie wentylacji, do stosowania w placówkach ochrony zdrowia

A-Series BiPAP Hybrid A30
Znany również pod nazwą BiPAP Hybrid A30 (A-Series)
(niedostępny w USA)

Respirator A-Series BiPAP V30 Auto
Znany również pod nazwą BiPAP V30 Auto(A-Series)
Respirator do wentylacji ciągłej nieprzeznaczony do podtrzymywania funkcji życiowych

A-Series BiPAP A40
Znany również pod nazwą BiPAP A40 (A-Series)
(niedostępny w USA)

A-Series BiPAP A30
Znany również pod nazwą BiPAP A30 (A-Series)
(niedostępny w USA)
Jeśli posiadasz wadliwe urządzenie…
Które produkty są wolne od wad i dlaczego?
Produkty, w których nie występuje powyższy problem, mogą być wyposażone w piankę dźwiękochłonną wykonaną z innych tworzyw. Wynika to z faktu, że w miarę upływu czasu w urządzeniach wykorzystywane są nowe materiały i technologie. Pianka dźwiękochłonna może też znajdować się w innym miejscu z uwagi na odmienną konstrukcję urządzenia i dzięki temu nie powoduje występowania powyższego problemu.